Índice
Un esquema de la estructura atómica es una herramienta didáctica que ayuda a explicar, con apoyo visual y lenguaje claro, la forma de cómo está constituida la materia y por qué los elementos se comportan como lo hacen. Así pues, esto no solamente es fundamental para estudiantes y profesionales de la ciencia, sino también para cualquiera que desee entender cómo funciona el universo a un nivel esencial.
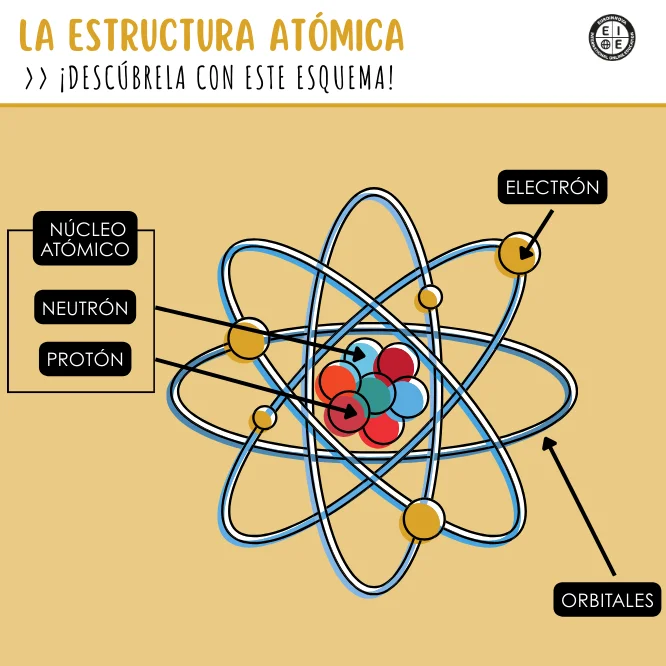
Las partes de la estructura atómica son las siguientes:
El núcleo se ubica en el centro del átomo y concentra casi toda su masa. Es muy pequeño respecto del tamaño total del átomo, pero determina propiedades esenciales como el número atómico y la identidad del elemento.
Puede representarse como una región compacta, separada espacialmente de la zona donde se localizan los electrones.
Son partículas con carga eléctrica positiva. Su cantidad define el número atómico (Z). Cambiar el número de protones cambia de elemento, tal como, por ejemplo, de sodio a magnesio.
No tienen carga eléctrica neta y aportan masa. Variaciones en su número generan isótopos (carbono‑12, carbono‑14).
Así pues, ciertos isótopos son estables; otros son radiactivos y decaen con el tiempo. Para definiciones canónicas de estructura atómica (átomo y componentes), se puede consultar el compendio de la IUPAC.
Los electrones rodean al núcleo y, a diferencia de las viejas órbitas circulares, se describen mediante funciones de onda (orbitales) y niveles de energía cuantizados.
En la práctica docente, basta con explicar que no “giran” como planetas, sino que tienen mayor probabilidad de encontrarse en ciertas regiones del espacio. En un esquema de la estructura atómica hay que mostrar capas/energías y ejemplos de subniveles s, p, d, f.
Para estudiar valores reales de niveles y transiciones de distintos elementos, una referencia sólida es la Atomic Spectra Database de NIST, en la que pueden consultarse niveles de energía y líneas espectrales evaluadas por expertos.
Órbita es una trayectoria definida, mientras que, orbital es una función de probabilidad. Bohr habló de órbitas y, la mecánica cuántica moderna usa orbitales. En clase, evita usarlas como sinónimos y distingue su uso según el modelo.
El modelo de Bohr funcionó muy bien para explicar el hidrógeno y los saltos entre niveles y líneas en el espectro. Sin embargo, este no describe con precisión átomos polielectrónicos.
Por su parte, el modelo mecánico‑cuántico, basado en Schrödinger y en el concepto de orbital, generaliza el fenómeno y permite predecir geometrías y enlaces. Introducir ambos en el esquema ayuda a entender por qué coexistieron y cómo evolucionó la teoría.
Los modelos atómicos a lo largo de la historia son los siguientes:
Propuso que la materia está compuesto de partículas indivisibles (átomos) y que los compuestos son combinaciones simples de estos.
Aunque actualmente sabemos que un átomo sí tiene partes, Dalton explicó con éxito las leyes ponderales de proporciones definidas y múltiples.
Tras descubrir el electrón, Thomson sugirió el famoso pudín de pasas de carga positiva difusa con electrones incrustados.
El valor didáctico de este modelo es histórico, puesto que, muestra un primer intento por explicar la estructura interna con la evidencia de su época.
Experimentos de dispersión de partículas alfa sobre láminas metálicas ultra delgadas mostraron que la masa y la carga positiva se concentran en un núcleo muy pequeño, desbancando el modelo de Thomson.
Representa el núcleo compacto y el espacio casi vacío alrededor en tu esquema de la estructura atómica, para que el grupo entienda por qué la mayor parte del átomo es vacío.
El modelo de Bohr introdujo niveles de energía cuantizados y los electrones solamente pueden ocupar ciertas energías y emiten/absorben fotones al saltar entre ellas.
Esto explica con elegancia las líneas espectrales del hidrógeno que, de hecho, puedes contrastar con datos reales en la base de NIST.
Describe electrones como funciones de onda. Los orbitales (s, p, d, f) y sus orientaciones surgieron de soluciones de la ecuación de Schrödinger.
Este enfoque explica estructura electrónica, periodicidad y enlaces con mayor precisión que Bohr, aunque requiere más abstracción.
Comprender estructura atómica es esencial para explicar periodicidad, tipos de enlace, propiedades de materiales y fenómenos como la conducción eléctrica o la reactividad.
En el contexto mexicano, el Plan de Estudio 2022 de educación básica enfatiza el uso de modelos científicos, el trabajo con evidencia y la contextualización de contenidos de ciencias naturales.
Se puede conectar el esquema de la estructura atómica con problemas reales, tales como, por ejemplo, por qué ciertos materiales son aislantes o conductores, mejorando de esta forma la motivación y el aprendizaje significativo.
A continuación, presentamos un ejemplo de un esquema de la estructura atómica:
Título y foco: “Esquema de la estructura atómica de sodio (Na)”.
Núcleo: indica Z = 11 (protones) y, si aplica, un isótopo concreto con su número de neutrones (por ejemplo, 12).
Electrones por niveles: 2–8–1 (modelo simple por capas para el nivel educativo indicado).
Subniveles: muestra s y p en el segundo nivel y el electrón de valencia en 3s.
Leyenda: diferencia en el esquema de la estructura atómica (representación) vs. modelo (supuestos), aclarando que los orbitales son probabilísticos.
Apoyo con datos: si deseas trabajar con niveles y transiciones reales, consulta la Atomic Spectra Database de NIST.
Contexto: relaciona el electrón de valencia con reactividad del sodio y ejemplos cotidianos, tales como, sales y procesos industriales presentes en el entorno local.
Algunas de las actividades para aprender la estructura atómica son las siguientes:
Entrega una plantilla con el núcleo y círculos concéntricos para niveles. Pide al grupo ubicar protones y neutrones, así como distribuir electrones según Z, cuidando que se entienda la diferencia entre nivel y subnivel.
Asimismo, reafirma el vocabulario, es decir, estructura, atómica, orbital, nivel, subnivel.
Prepara tarjetas con pistas, tales como: “tengo carga positiva”, “no tengo carga”, “determino la identidad del elemento”. Quien acierte la partícula, explica su función dentro de la estructura atómica.
En equipos, coloquen a Dalton → Thomson → Rutherford → Bohr → cuántico. Debajo, anoten la evidencia clave que justificó cada salto de modelo, como descubrimiento del electrón, dispersión de partículas alfa, espectro de hidrógeno y formalismo cuántico.
Esto entrena el pensamiento histórico de la ciencia y, en vez de ver los modelos como errores, estos se considerarán pasos progresivos.
La materia que nos rodea, comprende desde el aire que respiramos hasta la tecnología que usamos a diario, se encuentra compuesta por átomos, los cuales son diminutos elementos que constituye la base de toda la química y la física moderna.
Dominar el esquema de la estructura atómica te da un lenguaje común para entender materiales, energía y reacciones, así que, si enseñas o estudias química y quieres reforzar fundamentos en este ámbito, es el momento de formarte.
Quizá te interesa leer sobre:


¡Muchas gracias!
Hemos recibido correctamente tus datos. En breve nos pondremos en contacto contigo.